三級アミン触媒 TEDA®|有機化成品|東ソー
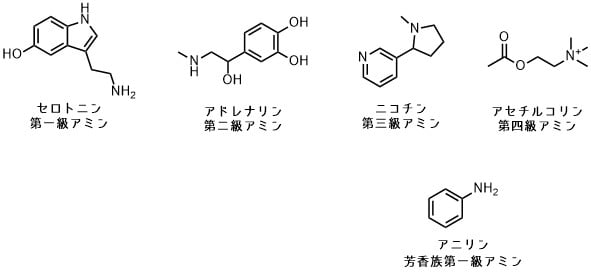
アミンの一般構造式 アミン amine とは、のを基または原子団でしたの総称である。 置換した数が1つであれば 第一級アミン、2つであれば 第二級アミン、3つであれば 第三級アミンという。 また、が第三級アミンに結合して となる。 一方アンモニアもアミンに属する。 、として広く利用される。 アミノ基 アンモニア、第一級アミン又は第二級アミンから水素を除去した1価の官能基 -NH 2,-NHR,-NRR' を アミノ基と呼ぶ。 芳香環上に置換するととしての性質を示す。 物性 アミンは塩基性を有し、(水素陽イオン)が配位結合する。 これは、原子がを持つためである。 アミンの塩基性の強さは窒素原子に結合していると密接な関係がある。 炭素数が同じ場合、第二級アミンは第一級アミンより塩基性が強い。 これは、アルキル基が持つ電子供与性によって窒素原子が負に分極することに拠る。 しかし、第三級アミンは第二級アミンよりも塩基性が小さい。 これは、アルキル基が3つ存在することでをもたらすためである。 また、一般に芳香環に直結したアミンは塩基性が低い。 これは芳香族炭化水素のもたらす非局在化による。 一般的なアミンの窒素原子はピラミッド型の構造をとる。 このため3つ違う置換基のついたアミンは一見光学活性となりそうに見えるが、実際には窒素が反転を起こしやすいため、特殊な場合を除いてを持たない。 しかし、に初めて合成されたはのかさ高さのために平面構造をとることが判明している。 のアミン類は微生物による発��・腐敗生成物中に普通に存在し、醸造酒中にも存在する。 ヒスタミン、チラミン、フェネチルアミンなどいくつかの物質は、アレルギー様症状、高血圧、偏頭痛の生理作用を引き起こす事が知られている。 命名法 他にやがある場合はそちらを優先し、アミノ基を置換基とする。 単純な形のアミン 窒素原子に結合したアルキル基にアミンを続けて表記する。 CH 3NH 2 — メチルアミン• CH 3 2NH — ジメチルアミン• CH 3 3N — トリメチルアミン IUPAC命名法 以下に示すような方法がある。 主鎖のとり方などの詳細についてはを参照。 母体化合物 NH 3 をアザンとし、これを置換基名に付加する(この方法はあまり用いられていない)。 化合物の名称に対し、主基として接尾語「—アミン」を付加する(接合命名法)。 基の名称に対し、接尾語「—アミン」を付加する(基官能命名法)。 接頭語「アミノ—」を用いる(置換命名法)。 窒素を含むように主鎖をとり、その主鎖の中でメチレン -CH 2- 基が窒素に置き換わった位置を「n—アザ—」の形で示す(代置命名法)。 長鎖ポリアミンなどで利用される。 CH 3NH 2• メチルアザン• メタンアミン• メチルアミン• アミノメタン• アザエタン• CH 3 2CHN CH 3 2• ジメチル(プロパン-2-イル)アザン• N, N-ジメチルプロパン-2-アミン• ジメチル(プロパン-2-イル)アミン• 2-(ジメチルアミノ)プロパン• 2,3-ジメチル-2-アザブタン また、許容慣用名が認められている化合物がいくつかある。 C 6H 5NH 2 —• CH 3C 6H 4NH 2 (パラ置換) —• H 2-C 6H 4-C 6H 4-NH 2 (いずれもパラ置換) — CA命名法 IUPAC命名法の 2 を用いる。 ただし位置番号は置換基の前に付ける。 CH 3 2CHN CH 3 2 — N, N-ジメチル-2-プロパンアミン 合成法 置換反応 アミンはやアルキルなどに対し、やアミンなどが求核剤としてはたらく置換反応により合成される。 ただし、立体障害の小さい基質の反応などでは、生成したアミンがさらに求核剤としてはたらき、二級、三級のアミン、さらに四級のとなる副反応が起こってしまう。 このことは、特に一級アミンを合成したい場合に問題となる。 その解決法として、カリウムとハロゲン化アルキルを反応させて N-アルキルフタルイミドとし、続くなどで一級アミンを得る、が行われる。 またハロゲン化アルキルとなどを反応させてアルキルアジドとし、これを還元(後述)する方法も有用である。 基(芳香族基)をアミン上に導入する置換反応は、その芳香環上の適当な位置にがあるハロゲン化アリールの場合は S NAr 機構により進むことがある。 活性の低いハロゲン化アリールでも、やといった、や化合物を媒介とする反応によりアリールアミンへと変換できる。 還元反応 アミンはまた、、、、、、、などの還元によっても得ることができる。 LAH 、パラジウム触媒-系などが用いられる。 などの手法によれば、やから、イミンを経由してワンポットでアミンを得ることができる。 酸性条件下、 NaBH 3CN や-錯体などを用いて還元を行うのが普通である。 この形式の人名反応として、の例がある。 加水分解 アミンは、アミド、イミン、などを加水分解すると、対応するアミンが得られる。 イソシアネートは、などの生成物であるため、それらの反応を含水系で行った場合は生成物としてアミンが得られることになる。 人名反応 アミンを生成物とするとしては、上記に挙げたもののほか、、、ゾムレー・ハウザー転位、スチーブンス転位、などの転位反応や、、、などの求核的反応が挙げられる。 反応 第一級および第二級アミンはやと縮合してを作る。 また、などの適切な脱水剤や脱水反応により、と反応させてとすることができる。 第一級アミンはやと縮合するとに変わる。 第二級アミンは同様にを与える。 第二級、第三級アミンは酸化銀などの存在下でを起こし、一級下位のアミンととなる。 この反応ではという位置選択則が働く。 アミンは酸化によって、、、となる。 第一級アミンにあるいは亜硝酸エステルを作用させるとイオンとなる。 これはやなど、の基質となる。 アミンを用いる人名反応としては、これまでにすでに述べたものや合成法として述べたもののほか、、ストークエナミン合成などが知られる。 微生物による産生 食品腐敗の際に微生物によってもアミノ酸から産生される。 Hunig's base• TMEDA• 芳香族アミン• (プロトンスポンジ) 複素環式アミン• 1,4-ジアザビシクロ[2. 2]オクタン• アミン誘導体• 関連物質•
次の
第四級アンモニウムカチオン

毎回自分の初歩的な質問に分かりやすく説明していただきありがとうございます。 今回も質問させていただきます>< アミンについてなのですが、 1 アミンは分極した結合と非共有電子対をもっているので水素結合を形成することを本で読みました。 その後に、「炭素数の少ないアミンは水と水素結合形成するため、水に良く溶ける。 」と、書いてあったのですがこの文の意味があまり理解できません。 この文章にある炭素のどんな効果が水と水素結合を形成するにあたって障害になるのでしょうか?? 2 アミンとハロゲン化アルキルの反応についてですが、「過剰のハロゲン化アルキルを用いると最終的に第四級アンモニウム塩まで反応が進む。 」と本に書いてありました。 たとえば第一級アミンとハロゲン化アルキルが反応した場合、第三級アミンの塩が得られますよね?? それならば上の文では第四級アンモニウム塩ではなくて第四級アミンの塩と表記しても間違いないのですか?? 非常に読みにくい文章で申し訳ありません。 ぜひ回答よろしくおねがいします>< 1 アミンは水と水素結合を作る。 このことは水に溶けやすくなる要因になる。 その一方で炭素が多くなると、そのアルキル基の影響で疎水性が増し、水に溶けにくくなる要因になる。 結局はそれらの2つの要因が総合的に作用して水に対する溶解度が決まります。 すなわち、炭素が多くなると、アルキル基の疎水性が水素結合に基づく親水性に勝り、水に溶けなくなるということです。 ・・似たようなことはアルコールでも起こります。 炭素数の多いアルコールもまた水には溶けません。 2 >第四級アミンの塩と表記しても間違いないのですか?? 間違いです。 「第四級アミン」というもの自体があり得ません。 すなわち、アンモニア NH3 のHのうちのいくつかがアルキル基などで置き換わったものがアミンです。 アンモニアのHは3個しかありませんので、アミンも第三球までです。 第四級アルコールもあり得ないのと似たようなことです。 >たとえば第一級アミンとハロゲン化アルキルが反応した場合、第三級アミンの塩が得られますよね?? 「塩」というからにはアンモニウム塩です。 たとえばメチルアミンがクロロメタンと反応すれば下記のようになります。 「アミン」を使いたいのであれば、「ジメチルアミンの塩酸塩」とでもいった方が良いでしょう。 なお、この場合でも、最終的には第四級アンモニウム塩であるテトラメチルアンモニウム塩(塩化テトラメチルアンモニウム)が生じます。 A ベストアンサー 要は、「電気陰性度の大きい原子に結合した水素と、電気陰性度の大きい原子の間の静電的な引力」です。 電気陰性度の大きい原子というのは、事実上、F,O,Nと考えて良いでしょう。 水素が他の原子と違うのは、その価電子が1個しかないことです。 他のイオンの場合には、内側にも電子格殻が存在しますので、原子格がむき出しになることはありません。 もちろん、正電荷を持つ水素というのは水素イオンとは異なりますので、原子殻がむき出しになっているわけではありませんが、電子が電気陰性度の大きい原子に引き寄せられているために、むき出しに近い状態になり、非常に小さい空間に正電荷が密集することになります。 そのときの、水素は通常の水素原子に比べても小さいために、水素結合の結合角は180度に近くなります。 つまり、2個の球(電気陰性度の大きい原子)が非常に小さな球(水素原子)を介してつながれば、直線状にならざるを得ないということです。 要は、「電気陰性度の大きい原子に結合した水素と、電気陰性度の大きい原子の間の静電的な引力」です。 電気陰性度の大きい原子というのは、事実上、F,O,Nと考えて良いでしょう。 水素が他の原子と違うのは、その価電子が1個しかないことです。 他のイオンの場合には、内側にも電子格殻... Q 初めて書かせていただきます。 誤字脱字、わかりづらい点などあるかもしれませんがよろしくお願いします。。。 先週から学校で実験をしておりまして、インドメタシンの合成をしています。 インドメタシン合成の出発物質は4-methoxyphenylhydrazineと言うのですが、これを買うとなると塩酸塩の状態ででしか購入できませんでした。 塩酸塩では都合が悪いので、それを取り除きたいのですがうまくいかなくて困ってます。 試した手順としては、トルエン(3回目からは酢酸エチル)に入れてみて、溶けなかったので水を加えて溶かし、溶けない場合は一時的にドライヤーで温めて溶かす。 それにNaOHを加えて攪拌。 その後、有機層を取り出してエバポレーターで抽出したのですが・・・。 NMR等で調べると構造が壊れてしまっているらしくうまく取り除けません。 何かよい方法はないでしょうか? A ベストアンサー 研究室での実験ですか? 授業での実験ですか? 研究室であれば、まずは上級生に聞いてみてください。 ・4-methoxyphenylhydrazineですが、塩酸塩でしか手に入らない理由は 何だと思いますか? ・酢酸エチルとヒドラジンを混ぜて加熱するとヒドラジドが生成します。 (つまり反応してしまいます) NaOHで中和するのはokと思います。 溶けなくてもよいので水とトルエン中で 撹拌、その後容器を冷やしながら塩酸分の中和に必要なNaOH水溶液(当量を 計算してください)ゆっくり滴下。 おそらくフリーのヒドラジン(塩酸塩ではないヒドラジン)が トルエン層に分配してくる(トルエンに溶解する)のではないでしょうか。 それをなるべく冷却したまま分液、分液したトルエン溶液は、なるべく早く次の反応に使う。 (保管時間は短くする) このような方法でどうでしょう。 A ベストアンサー 実際にデータを見たことがないので理詰めになりますが 一応お答えします。 もともと水素結合とは電子が不足している水素を 電子が余っている酸素が引き付けることで発生します。 つまり酸素の持つ電子が多ければ多いほど結合が強くなる ともいえます。 水素は取れる電子が少ないので無視です。 『え、酸素が持ってる電子はどれも同じじゃないの?』と 思われるかもしれませんが実際には電気陰性度の強さによって 多少の差があります。 電気陰性度はどれだけ電子を強く引き付けるかを表すもので 酸素はこれがかなり強いです。 カルボニル基は2つの酸素が炭素の 電子を奪い合っているため、相対的にひとつの酸素の取り分は 水酸基の酸素に比べて少なくなります。 そのため水素結合は水酸基のほうが強いと思います。
次の