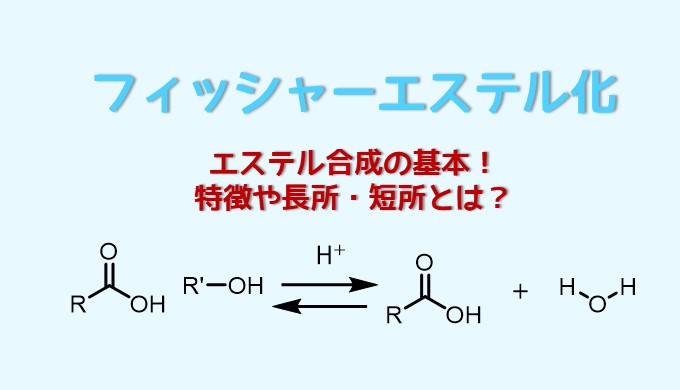
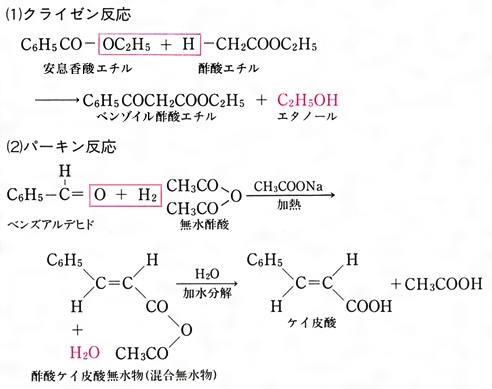
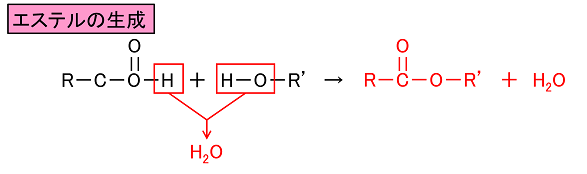
エステルの加水分解でカルボン酸を得る反応機構 塩酸や塩基の方法
物理化学 酢酸エチル加水分解の反応速度解析 1 、目的 水が大過剰に存在する条件下で、微分法、積分法を用いて、酢酸エチル加水分解反応の速度が、酢酸エチル濃度に対して、擬一次反応として取り扱える事を確認する。 2、理論、実験方法 実験方法変更点 第1日目(1)10 ml 駒込ピペットではなく、5 ml 駒込ピペットで N a OH を測った。 第1日目(3)20 ml ポールピペットではなく、25 ml ポールピペットを用いて、 KHP を25 ml 測り取った。 第1日目(8)塩酸を20 ml 測り取るのでなく、塩酸を40 ml 測り取った。 第2日目(8)塩酸を入れる200 ml 三角フラスコは乾燥済みのものを使用した。 また、塩酸を測るのに必要な20 ml ポールピペットは、アセトンで乾燥済みのものを使用した。 第2日目(13)酢酸エチルを測り取るのに必要な5 ml ポールピペットは、アセトンで乾燥済みのものを使用した。 実験方法の誤って行った作業 第2日目(17)60分におけるサンプルの酢酸エチルを水酸化ナトリウムで滴定を行った。 ) 今回の水酸化ナトリウムの平均値は、採用した値がすべて近いので平均値は有効数字4桁目の上付きに 5桁目を加えておくとする。 ) 今回の水酸化ナトリウムの平均値は、採用した値がすべて近いので平均値は有効数字4桁目の上付きに 5桁目を加えておくとする。 今回の反応機構を考えると 今回は一般のカルボン酸エステルの酸加水分解反応を記述する。 この素反応の中で律速反応になるのは 2 の反応である。 つまり今回の酢酸エチルの減少速度はこの(2)の速度で決まるということになる。 ) この上の式から今回の酢酸エチル加水分解反応速度における酢酸エチルの反応次数を1次として考えることは正しく、また、上の式から、酸触媒は酢酸エチルの加水分解速度に影響を与えると推測される。 次にこの反応機講を取る理由について考えていく、まず、 Day と Ingold が提案した実験的根拠がある機構 6 つの機構と可能性のある2つの機構に関して、考えてみるこの時の次に挙げる 6 つの機構は遅い過程である。 それは、立体障害効果は、しばしば誘起効果や共鳴効果でマスクされてしまうからである。 その上、立体障害に反応機構を変える事もある。 表 16 に示した効果もそれ程直裁簡明なものではないため、実際に機構を決定する道は簡単でない。 まず酢酸エチルの酸加水分解反応を取り上げて、いろいろの証拠をまとめてみる。 このタイプの反応では、これらの機構は実験事実により否定される。 つまり標識原子はさんのほうに移るがアルコールには移らないから、切れるのはカルボニルの炭素とアルコール側酸素間の結合であるということになる。 両者とも同じ予備平衡があり、プロトンのエステルへの移行が起こっている。 したがって活性錯体と初期状態よりやや大きいエントロピーと、大きい体積を持つことになるだろう。 これに加えて、活性錯体の極性も著しくなるから、エントロピーと体積は減少するであろう。 すなわち、 (1)反応点の付近にかさばった置換基を入れると、速度が減少する。 その効果は、置換基の普通の誘起効果や共鳴効果だけでは説明できない。 (2)溶媒の誘電率を増すと反応は著しく速くなる。 次に、予備平衡における体積変化は小さいであろうから、遅い段階では活性化体積は負である。 また、 W halley 機構を決定するには、活性化体積のほうが、活性化エントロピーよりも信頼できることを強調している。 この上の表からプロットを図に取りグラフにすると(図6参照)これらの点を取るグラフは 1 つの直線を形成しない。 また図 2よりn=1次反応のほうは、ほとんどの点が直線状にのる為、nは2次反応ではなく1次反応と仮定したものほうが結果は直線状にのり一致することになるため、今回の酢酸エチル加水分解反応はこの点からもn=1次反応と考えてよいと推測する。 また、図2も見るとすべての点がほぼ直線状になっているのは正しいと推測される。 次に図3から求めた反応速度定数をアレーニウスの式を用いて、活性化エネルギーを求めた。 今回アレーニウスの式を使える理由は、今回は1次反応であるからである。 よって、それから求められる値はほぼ正しいのでないかと推測する。 また、もしも酢酸エチル用の5mlポールピペットは色が黄色なので、間違えることはないと思われる。 (水の分解によるプロトンと水酸化物イオンが少し存在したとしても) 同様に塩酸のポールピペットも色が異なるので間違えないと思われるが、間違うと、ポールピペット中にある塩酸の量は少ないが高濃度なので中に0.01ml残っていたとしても、0.025Nの水酸化ナトリウムで0・8ml加えることになるので,滴下量の値があまりずれることにならないだろう。 そして表8と比較して1回目の滴定量に差がほとんど無いため、これは有り得る可能性は有ると思われる。 次に、私はきちんと目盛りを2回確認して書くことにしているし、3回目の終期滴下点と4回目の初期滴下点木賃お同じで書いてあったため、この2つの点における間違いはないと予想する。 もしかしたら3回目の初期点と4回目の終期点に間違えがある可能性は有るとは予想される。 今回の反応は2ml酢酸エチルの初期における反応量を測る実験であるから、結果に表だって出てくるほど酢酸エチルが少なすぎて、反応量は減少することはないと考えられる。 次に水酸化ナトリウムのファクターの変化似ついて考えてみると、ポリビーカーに保存しているとしてもポリビーカーの中に空気中の水分子は入ることが可能であり、ビーカーに水酸化ナトリウムを入れておいていたままにする間に、同様のことが起こるだろう。 しかし、それでも水酸化ナトリウム中の水分子も蒸発することも同時におこりえ、また1日置いておいたままなので急激なファクター変化は起こらないものと予想される。 また1回目の酢酸エチル2mlのグラフは直線よりも2次関数に近いグラフであったことや、1回目滴定の値が取れなかったことや、今まで上記に述べていたことなども考えてもう1回実験をやることは正しいと推測します。 まずこの1回目の滴定量(V t)が18.12(ml)であり2mlにおける前回の1回目の滴定量に比べて大きいすぎるためだ思われる。 今回この実験を始める前に塩酸、試薬の酢酸エチル、サンプリングの酢酸エチル用のポールピペットを先にとも洗いした後、すぐにその物質の実験操作を行ったため、例え違ったポールピペットを使ったとしても体積モル濃度の変化は起こらないはずである。 またビュレュトの目盛りを読み違えたかということについては前回と同様な理由から、初期滴下点と終期滴下点の目盛りの読み間違えはないと思われるが、初期滴下点が間違っていることはあるかもしれない。 これは前回の2mlにおける酢酸エチルの滴定量が正確な値が出ていなくともおかしい。 また酢酸エチルの滴下量が少なかったのではないかということについては今回の滴定操作で用いる酢酸エチルのポールピペットは2 ml と一番少ないものであったあらこれ以上少なくなることはないと考えられる。 また、今回の滴定操作における水素イオン濃度の変化については、この滴定操作で使われるポールピペレットは操作を行う前に共洗いを行ったので、各物質のモル体積濃度の変化は起こらないと思われる。 塩酸のポールピペットでもし試薬酢酸エチルを取ったとしても共洗いを行っている時点でそのモル体積濃度は起こらないと考えられるし、これは5mlのものでもあるので、逆に滴下量は増加するだろう。 サンプリング酢酸エチルの場合も同様でモル濃度変化は起こらないだろう。 また、2mlの酢酸エチルのポールピペットを用いたとすると、それは水酸化ナトリウムの滴下量を2.5倍程度にしたものと考える。 つまり今回の滴下量が前回の滴下量の2.5倍程度になると推測される。 実際そんな値を取らないので、2mlのポールピペットを使ったとは考えられない。 また、ビュレットの目盛りのミスについて考えてみると、2回目の初期滴下値と3回目の初期滴下値、終期滴下値はデータのつながりからほぼ間違いがないかと思われる。 2回目の終期値はデータのつながりから考えることができないため間違っている可能性があると思われる。 また、ビュレットの目盛りを4回目の終期滴下値もデータのつながりがないので間違っている可能性があると思われる。 今回の場合、滴定操作はビュレットの目盛りミスが原因であると考えられる。 またこのデータは全体的に小さすぎる値をとるので、酢酸エチルの反応量の図 反応次数の計算の図 より除外して考えるべきだと思われる。 今回の実験法は酢酸エチルの反応が遅く進む酸加水分解反応を用いたこととで実験の初期における反応の進み具合が塩基加水分解反応を用いたことで求めるグラフの値より多くとることができるようになり、正確にグラフを書けるようになると考えられるので、この方法でいいと思われる。 塩基触媒がなぜ反応を速めるかということは、求核試薬である水酸化物イオンはかなり強いルイス塩基で、これはカルボニル炭素を襲い、今回は親電子試薬である水分子がアルコール側の炭素を襲いプロトン移行が起こる。 そして、エステルの酸中の電子吸引性置換基(たとえば NO 2 )は活性化エネルギーを減少させ速度を増加させる効果をもつ。 この理由は、この種の置換基は親電子試薬のカルボニル炭素原子攻撃を容易にする。 (参考文献1) 触媒作用の機構 ある物質が正の触媒となる。 つまり、反応速度を増すためには、触媒のない場合折、有利な反応経路を提供するということである。 それは、自由エネルギー図形を用いて模式的にした図のように描かれる。 正触媒作用を受けた反応の自由エネルギー障壁は、触媒のない場合より低いから、前者のほうが反応速度は大きい。 触媒作用を受けた反応の活性化自由エネルギーは低下するが、これは中間体のエントロピーが高いためであると考えられる。 要は、これらの中間では、会合分子数は触媒のない場合よりも少数ですむということである。 これに加えて、中間状態の全エネルギーが低下することが多い。 これは比較的安定な中間錯体を形成するためである。 (参考文献2) 触媒反応は主に2つに分けられる。 均一系触媒反応と不均一触媒系反応である。 均一系反応では、触媒と反応物質がともに同一相に存在して触媒反応が進行する反応では気相で進行する場合や、液相で進行する場合がある。 ここで、均一触媒系反応は、反応機構が詳細にわかる。 なぜなら全体が反応の場となる均一系触媒反応では、たとえば、分光学的方法、核磁気共鳴スペクトル等の方法の適用で得られたスペクトルの解析が容易であるからだ。 均一系触媒反応には酸塩基触媒反応、遊離基反応、金属錯体触媒反応、酵素反応などがある。 不均一系触媒反応機構は、反応物質と相を異にする反応であり、実際、触媒が固体で反応物質が気相、あるいは、液相に存在するのかが普通であり、不均一触媒反応は固体触媒反応と同義語と考えられる。 固体触媒反応は反応経路に固体触媒表面と反応分子が関与する素反応がある。 不均一触媒反応にもっとも特徴的な素反応は表面への反応分子と吸着過程と吸着状態での反応、つまり原子の組換えがおこる。 吸着には、比較的弱いところの分子間相互作用によって起こる吸着を物理吸着、より近接力であり強いところの科学的な結合力によるものを科学吸着と呼ばれる。 また吸着速度、吸着平衡に達する吸着と発熱、触媒表面構造、共同効果などの要素がたくさんある。 今回の実験は反応物質酢酸エチル、水そして、触媒として塩酸(水素イオンが触媒になる)があり、それらはすべて液相であり、液相で反応が行われるため、均一系触媒反応である。 (参考文献3) 活性化エネルギー 一般に系が一つの安定な状態からほかの安定な状態に移るには、その中間に存在するエネルギーの高い状態を経なければならない。 この状態を遷移状態という。 (図の7参考)つまり、反応の進行に必要なエネルギーの閾値であると考えることができる。 (参考文献4) 活性錯体 化学反応が始原系から生成系にむかって進行するとき、反応化学系のギブスの自由エネルギーが最大となる状態を経由する。 この状態を遷移状態という。 反応のポテンシャル局面で考えると遷移状態は反応座標に沿った鞍点にある反応系は、反応座標に沿った運動方向を除けば、通常の分子と同じように、分子の運動や回転を定義することができる。 このように考2られた理想の分子を活性錯体と呼ぶ。 活性錯体はポテンシャル局面上の鞍点で定義される仮想の分子出会って、極小点で定義される反応中間体とは異なることを考える必要がある。 つまり初期の酢酸エチルの体積モル濃度に対数をとった値であるからln(〔CH 3COOC 2H 5〕 0)と書ける。 時間帯が違えば値に多少のずれは生じるだろうが、それでも無視できると思われる。 水溶液は強アルカリ性(参考文献5) 塩酸 塩化水素の水溶液で濃厚なものは湿った空気中で著しく発煙する刺激臭ある無色の溶液。
次の